Fragen zur Umsetzung von wissenschaftlicher Evidenz in die Praxis
Frage 1: Wenn ein Patient an einer lebensbedrohlichen Krankheit leidet, lohnt es sich dann nicht, alles Erdenkliche zu versuchen?
Es kann durchaus verlockend sein, das neueste «Wundermittel» auszuprobieren oder dem Beispiel von Prominenten zu folgen, die in der Boulevardpresse Behauptungen über eine Therapie aufstellen, die sie selber ausprobiert haben wollen, vielleicht sogar ein «alternativmedizinisches» Verfahren, das sich gut verkauft, das aber nie getestet wurde. Schulmedizinische Maßnahmen muten dagegen mitunter sehr viel weniger glanzvoll und vielversprechend an. Die meisten dieser Therapien, die bei lebensbedrohlichen Krankheiten zur Anwendung kommen, sind jedoch gewissenhaften Tests unterzogen worden, um herauszufinden, wie wirksam und unbedenklich sie sind. Sich also zunächst einmal mit der besten Evidenz vertraut zu machen, kann viel Zeit, Kummer und Geld sparen.
Im Großen und Ganzen erkennt die Schulmedizin an, dass hinsichtlich der Wirksamkeit und Unbedenklichkeit der auf dem Markt befindlichen Medikamente gewisse Unsicherheiten herrschen. Sie ist deshalb bestrebt, diese Unsicherheiten durch Tests sowie die ständige und systematische Auswertung der Evidenz auf ein akzeptables Maß zu verringern, um die angebotenen Therapien auf diese Weise zu verbessern. Solche Verbesserungen hängen in ganz entscheidendem Maße von der Mitwirkung von Patienten ab, die erkannt haben, dass dies die einzige Möglichkeit ist, um einen dauerhaften Fortschritt zu erzielen.
Verständlicherweise sind Patienten mit lebensbedrohlichen Krankheiten entschlossen, alles Mögliche auszuprobieren, auch ungeprüfte «Therapien». Für sie wäre es aber deutlich besser, wenn sie die Teilnahme an einer für sie geeigneten klinischen Studie in Betracht ziehen würden, in der eine neue Therapie mit der derzeit besten Behandlung verglichen wird. Ein solcher Vergleich deckt nicht nur auf, welche zusätzlichen Vorteile die neue Behandlung möglicherweise mit sich bringt, sondern auch, welche Schäden sie hervorrufen könnte. Lebensbedrohliche Krankheiten bedürfen mitunter hoch wirksamer Therapien – und es gibt keine Therapie, die nicht auch irgendwelche Nebenwirkungen hätte. Umso wichtiger ist es, dass eine neue Therapie gründlich und auf faire Weise getestet wird, um die Ergebnisse systematisch erfassen und feststellen zu können, ob sie den Patienten wirklich hilft.
Frage 2: Vielleicht möchten Patienten wissen, ob eine Therapie wirkt. Doch was ist, wenn sie nicht alle Einzelheiten erfahren wollen?
Es ist wichtig, das richtige Maß zwischen Informationsüberladung einerseits und dem Vorenthalten von brauchbaren Informationen andererseits zu finden, damit die Patienten eine ausreichend informierte Entscheidung treffen können. Ebenso wichtig ist es, daran zu denken, dass ein Patient, wenn er auf dem Weg zu einer Entscheidung jeweils das Für und Wider abwägen muss, anfangs nur wenige, im weiteren Verlauf aber mehr Informationen benötigt. Während der Konsultation sollte sich sowohl beim Arzt als auch beim Patienten das Gefühl einstellen, dass der Patient die Menge an Informationen erhalten hat, die er braucht, um im Weiteren gemeinsam mit dem Arzt entscheiden zu können, worin die derzeit beste Behandlungsmaßnahme für ihn besteht. Doch das ist noch nicht alles. Nachdem der Patient eine Weile über alles nachgedacht hat, hat er vielleicht noch weitere Fragen und möchte nähere Einzelheiten wissen. Dann sollte der Arzt ihm helfen herauszufinden, was er möglicherweise noch wissen muss, und ihm alles, was noch unklar ist, erklären.
Bei manchen Entscheidungen fällt die Abwägung schwer. Möglicherweise läuft es darauf hinaus, dass man das kleinere von zwei Übeln wählen muss. In Kapitel 4 haben wir beispielsweise über das Aortenaneurysma gesprochen – eine Aussackung der vom Herzen wegführenden Hauptarterie – bei dem es zur Ausbildung eines tödlich verlaufenden Gefäßlecks kommen kann. Das Problem kann durch einen größeren Eingriff behoben werden. Allerdings versterben ein oder zwei pro 100 Patienten bei der Operation selbst. In diesem Fall muss also die operationsbedingte Frühmortalität gegen das Risiko einer späteren tödlich verlaufenden Aortenruptur abgewogen werden. Langfristig ist eine Operation die bessere Wahl. Doch entscheiden sich manche Patienten nach eigenem Ermessen gegen diesen Eingriff oder schieben ihn zumindest auf, weil noch ein wichtiges persönliches Ereignis wie z. B. die Hochzeit ihrer Tochter ansteht. Anstatt sich also blindlings in eine Lösung zu verrennen, die als «einzige Hoffnung» anmutet, ist es besser, die jeweiligen Risiken und den richtigen Zeitpunkt abzuwägen.
Frage 3: Statistiken sind verwirrend. Sollten Patienten sich wirklich mit Zahlen befassen?
Wie Zahlen manchmal präsentiert werden, kann schon sehr abschreckend wirken – oder auch geradewegs in die Irre führen. Wenn Sie zwei Behandlungen aber wirklich miteinander vergleichen oder mehr darüber herausfinden möchten, wie sich eine Krankheit, an der Sie erkrankt sind, bei anderen Menschen auswirkt, kommen immer irgendwo Zahlen ins Spiel. Einige Darstellungsformen eignen sich dafür aber besser als andere.
Um die Bedeutung von Zahlen für medizinische Laien (und auch Ärzte!) zu veranschaulichen, eignen sich Häufigkeiten am besten. Das bedeutet, es wird mit ganzen Zahlen gerechnet. So ist beispielsweise die Formulierung «15 von 100 Personen» der Angabe 15 % generell vorzuziehen. Zudem hilft es oftmals, die Zahlen nicht nur mit Worten auszudrücken, sondern auch irgendwie graphisch darzustellen – z. B. in Form eines Balkendiagramms (Abb. 14), eines Kreis- oder Tortendiagramms, in Form von Strichmännchen/ Smileys und traurigen Gesichtern in Kästen etc. oder in Tabellenform. Zahlen mit dieser Art von «Entscheidungshilfe» darzustellen, gewährleistet, dass möglichst viele Menschen die Bedeutung der Daten verstehen.
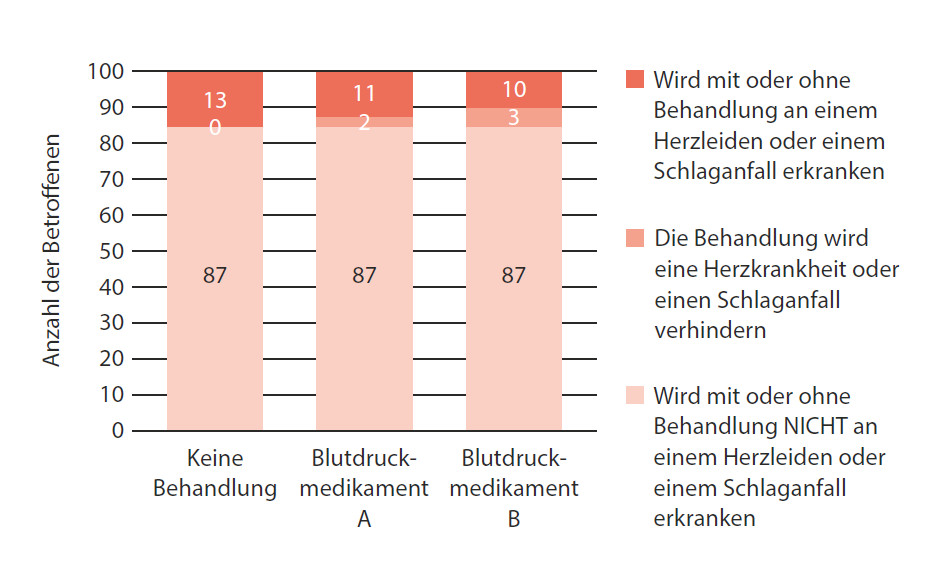
Abbildung 14: Was wird mit 100 Menschen in derselben Situation im Laufe der nächsten 10 Jahre passieren?
Um die Wirkung von Blutdruckmedikamenten auf das Risiko für eine Herzkrankheit und einen Schlaganfall bei Patienten mit Bluthochdruck im Laufe von zehn Jahren darzustellen, eignet sich beispielsweise ein Balkendiagramm. [3]
Von 100 Menschen mit nicht behandeltem Bluthochdruck werden in den nächsten zehn Jahren erwartungsgemäß 13 eine Herzkrankheit entwickeln oder einen Schlaganfall erleiden. Wenn alle 100 Personen das Blutdruckmedikament A nähmen, würden 11 von ihnen eine Herzkrankheit oder einen Schlaganfall bekommen – und bei zwei von ihnen ließe sich eine Herzerkrankung oder ein Schlaganfall vermeiden. Hätten alle 100 Patienten Blutdruckmedikament B eingenommen, dann käme es bei 10 von ihnen zu einer Herzkrankheit oder einem Schlaganfall, was bei dreien von ihnen vermeidbar wäre. Das ist einfach. Und doch werden diese einfachen Zahlen häufig in Worte gekleidet, die nur Statistiker verstehen können.
Sehen wir uns nun an, wie sich diese Zahlen statt in einem Balkendiagramm in einer Tabelle ausnehmen (Tab. 3). In diesem Beispiel konzentrieren wir uns auf die bessere Therapie – in diesem Fall Medikament B: Dazu wollen wir die Zahlen zunächst als natürliche Häufigkeiten (einfache Zahlen) ausdrücken, die wir uns im Anschluss genauer ansehen wollen.
| Keine Behandlung | Behandlung mit Medikament B | |
|---|---|---|
| Herzerkrankung bzw. Schlaganfall (im Laufe von 10 Jahren) |
13 von 100 Personen | 10 von 100 Personen |
| Keine Herzerkrankung bzw. kein Schlaganfall |
87 von 100 Personen | 90 von 100 Personen |
| Insgesamt | 100 | 100 |
Ohne Behandlung beträgt das Risiko für eine Herzerkrankung oder einen Schlaganfall 13 % (oder 13 von 100), während es bei Behandlung mit Medikament B 10 % (oder 10 von 100) sind – das macht einen Unterschied von 3 % (oder 3 von 100) aus. Da durch Medikament B drei von 13 Fällen einer Herzerkrankung oder eines Schlaganfalls verhindert werden, die sonst aufgetreten wären, beträgt die relative Risikoreduktion 3/13 oder ca. 23 %. Wir können also sagen, dass mit Behandlung B die absolute Risikoreduktion 3 % und die relative Risikoreduktion 23 % beträgt. Das sind zwei verschiedene Möglichkeiten, um ein und dasselbe auszudrücken.
Die relative Risikoreduktion gibt immer einen höheren Zahlenwert an – manchmal auch einen sehr viel höheren – und erregt deshalb auch deutlich mehr Aufmerksamkeit. Wenn Sie also irgendwo eine Schlagzeile sehen, in der es heißt: «23 % Schlaganfälle verhindert», dann sagt das gar nicht aus. Denn alle weiteren Angaben zur spezifischen Personengruppe der Betroffenen, zur Zeitspanne bzw., was am wichtigsten ist, zur Höhe des Schlaganfallrisikos ohne eine Behandlung fehlen. Sehr wahrscheinlich handelt es sich in diesem Fall um die relative Risikoreduktion (aber das müssten Sie prüfen).
Manchmal unterscheiden sich die Zahlen beträchtlich voneinander. Sehen wir uns einen Zeitungsbericht über eine Studie zum Prostatakrebs-Screening an: «Könnte die Zahl der Todesfälle um 20 % senken» klingt nach viel. Die Ergebnisse hätten aber auch anders ausgedrückt werden können, und zwar als 1 verhinderter Todesfall pro 1 410 gescreente Männer (oder als klitzekleine 0,07 %, d. h. die Verhütung von sieben vorzeitigen Todesfällen pro zehntausend gescreente Männer). Die 20 % geben die relative Risikoreduktion und die 0,07 % die absolute Risikoreduktion an. Letztere ist sehr viel niedriger, weil die Sterblichkeitsrate bei Prostatakrebs niedrig ist – und es wahrscheinlich nicht bis in die Schlagzeilen geschafft hätte. Die Quintessenz lautet: Wenn eine Behauptung in einer Schlagzeile viel zu optimistisch klingt, dann ist sie es wahrscheinlich auch! [4]
Es kommt also auf die Zahlen an, und richtig präsentiert können sie bei der Entscheidungsfindung sogar helfen. Patienten sollten sich nicht scheuen, ihren Arzt zu bitten, ihnen die Ergebnisse so zu erklären, dass sie sie auch problemlos verstehen können – bei Bedarf und wenn es der Klarheit dient auch mithilfe von bildlichen Darstellungen. Wenn Entscheidungen über eine Behandlung gemeinsam getroffen werden sollen, dann müssen sich Ärzte wie auch Patienten klar darüber sein, was die Zahlen tatsächlich bedeuten.
| Lassen Sie sich von aufsehenerregenden Statistiken nicht ins Bockshorn jagen |
| «Sagen wir, Ihr Risiko, im Alter zwischen 50 und 60 Jahren einen Herzinfarkt zu erleiden, ist um 50 % höher, wenn Sie einen hohen Cholesterinspiegel haben. Das hört sich ziemlich schlimm an. Wenn wir sagen, dass Ihr zusätzliches Risiko, einen Herzinfarkt zu bekommen, bei einem hohen Cholesterinspiegel nur 2 % beträgt, hört sich das für mich ganz in Ordnung an. Es handelt sich aber um dieselben (hypothetischen) Zahlen. Versuchen wir es einmal damit: Von hundert Männern zwischen 50 und 60 Jahren mit einem normalen Cholesterinspiegel werden vier erwartungsgemäß einen Herzinfarkt erleiden; dagegen ist zu erwarten, dass von hundert Männern mit einem hohen Cholesterinspiegel sechs einen Herzinfarkt erleiden werden. Das macht pro hundert zwei zusätzliche Herzinfarkte.»
Goldacre B. Bad Science. London: Fourth Estate 2008, S. 239–240. |
Frage 4: Wie kann ein Patient wissen, ob die wissenschaftliche Evidenz auf ihn zutrifft?
Alle Entscheidungen beruhen auf allen möglichen früheren – individuellen oder kollektiven – Erfahrungswerten. Faire Therapietests wie etwa randomisierte Studien sind gut strukturierte Versionen dieser Erfahrungen. Sie sind dazu ausgelegt, systematische Fehler auf ein Minimum zu begrenzen. Aber ob nun gut strukturiert oder nicht, es wird immer eine gewisse Unsicherheit bezüglich der Frage bleiben, inwieweit frühere Erfahrungen in eine Empfehlung für den nächsten Patienten einfließen können. Wenn also die Patienten, die in fairen Therapietests untersucht wurden, eine ähnliche Krankheit in einem ähnlichen Stadium oder mit einem ähnlichen Schweregrad hatten wie der fragliche Patient, dann lautet die vernünftigste Annahme, dass dieser Patient ähnlich auf die Therapie anspricht – es sei denn, es liegt ein guter Grund für die Annahme vor, dass die Studienpatienten ganz andere Eigenschaften hatten oder sich ihre Krankheit deutlich von der des fraglichen Patienten unterschied.
Aber auch wenn die Evidenz auf ihn anwendbar wäre, könnte der Patient natürlich zu Recht fragen: «Die Menschen sind doch alle verschieden. Also werden sie doch auch unterschiedlich auf Therapien ansprechen?» Ein «fairer Therapietest» sagt uns nur, wie eine Therapie im Durchschnitt wirkt, garantiert aber nur selten, dass sie bei allen Menschen gleich gut wirkt; und sie kann üblicherweise nicht vorhersagen, bei wem unerwünschte Nebenwirkungen auftreten werden. Die wissenschaftliche Evidenz kann Orientierungshilfen geben, welche Behandlung wahrscheinlich am besten ist, damit sie dann beim einzelnen Patienten ausprobiert werden kann. Bei einem Exanthem (ein entzündlicher Hautausschlag) beispielsweise könnte die evidenzbasierte Therapie auf eine Körperregion angewendet werden, während ein anderer Körperbereich als Kontrolle dient (s. Kap. 6, Möglichkeiten der unverzerrten (zufälligen) Zuteilung in Therapievergleichen). Durch den Vergleich des Ansprechens in den beiden Körperregionen können Arzt und Patient erkennen, ob die Therapie wirkt oder ob eine unerwünschte Wirkung auftritt. Wenn dermatologische Therapien – z. B. Aknetherapien im Gesicht – zum ersten Mal bei einem Patienten angewendet werden, ist es sogar üblich, zunächst einmal ein «Testpflaster» aufzubringen.
Meistens haben wir aber nicht das Glück, einen so direkten Vergleich zur Hand zu haben. Bei einigen chronischen und nicht lebensbedrohlichen Problemen wie Schmerzen oder Juckreiz kann man ein Medikament beim selben Patienten in bestimmten Zeiträumen wiederholt geben und absetzen. Ein solches Vorgehen wird auch als N-gleich-1-Studie (engl.: n-of-1 trial) bezeichnet; das bedeutet, dass die Anzahl der Teilnehmer (N) in der Studie eins beträgt – also einen einzigen Patienten umfasst. Die Prinzipien, die wir in Kapitel 6 für einen fairen Vergleich erarbeitet haben, gelten auch für solche Studien mit einzelnen Patienten, einschließlich einer unverzerrten oder verblindeten Bewertung des Behandlungsergebnisses usw. Im Idealfall würden wir für die Hauttherapien oder Tabletten dann Placebokontrollen einsetzen, aber das lässt sich oftmals nur schwer organisieren.
Bei vielen Krankheiten haben wir nicht die Möglichkeit, eine Therapie auszuprobieren und abzuwarten, was passiert: Das Behandlungsergebnis ist nicht zeitnah verfügbar oder zu ungewiss. Ob beispielsweise Aspirin bei einem Patienten einen Schlaganfall verhindert, kann man erst erkennen, wenn es zu spät ist. In der Präventivmedizin stellt das in den meisten Fällen ein Problem dar. Dasselbe gilt auch für die Behandlung zahlreicher akuter Erkrankungen wie z. B. Hirnhautentzündung (Meningitis), Lungenentzündung (Pneumonie) oder Schlangenbisse, bei denen wir keine Gelegenheit haben, die Therapie bei jedem einzelnen Patienten zu testen und abzuwarten. Deshalb sind wir darauf angewiesen zu prüfen, ob und wie wir die Evidenz aus den Erfahrungen mit der Untersuchung anderer Patienten anwenden können.
Wenn wir in der Praxis dann Glück haben und die Evidenz sich auf einen Patienten anwenden lässt, muss man sich unbedingt fragen, inwiefern sich der Schweregrad der Krankheit bei diesem Patienten (bzw. bei Gesunden das vorhergesagte Risikoausmaß) mit dem der Studienpatienten vergleichen lässt. Im Allgemeinen profitieren schwerer erkrankte Patienten stärker von einer Therapie als weniger schwer erkrankte. Wenn also der Schweregrad gleich oder höher ist als in den Studien, in denen der Nutzen einer Therapie nachgewiesen wurde, dann können wir in der Regel darauf vertrauen, dass sich die Evidenz auf unseren Patienten übertragen lässt. Wenn ihre Krankheit weniger schwer ist (bzw. die noch Gesunden ein vergleichsweise geringeres vorhergesagtes Risiko aufweisen), lautet die wichtigste Frage, ob auch ein Nutzen, der geringer als der in den Studien beobachtete ausfällt, noch als lohnenswert angesehen werden kann.
Frage 5: Bedeuten genetische Untersuchungen und «personalisierte Medizin» nicht, dass Ärzte für jeden einzelnen Patienten eine spezifische Therapie entwickeln könnten, und dass alles, was wir hier erörtert haben, damit hinfällig wird?
Obwohl der Gedanke, dass wir bei Bedarf für jeden einzelnen Patienten eine spezifische Therapie entwickeln könnten, zweifellos verlockend und für einige wenige Krankheiten vielleicht auch machbar ist, so erscheint es doch sehr unwahrscheinlich, dass sich dieser Ansatz in der Behandlung von Patienten auf breiter Front durchsetzen wird. Wie wir schon im Zusammenhang mit der Besprechung genetischer Untersuchungen erläutert haben (Kap. 4, Genetische Tests: manchmal sinnvoll, oftmals unzuverlässig), hängt der Ausbruch der meisten Krankheiten nicht nur von komplexen Wechselwirkungen zwischen mehreren Genen, sondern auch von den sogar noch viel komplexeren Wechselwirkungen zwischen Genen und Umweltfaktoren ab.
Die Ergebnisse genetischer Analysen sind wichtig als Entscheidungshilfe für Familien und Einzelpersonen mit erblichen Krankheiten wie Chorea Huntington, Thalassämien (erbliche Blutungsstörungen) sowie einigen anderen (meist seltenen) Krankheiten. Diese genetischen Informationen erweisen sich bei der Beratung von Familien, in denen diese Krankheiten gehäuft auftreten, als großer Segen. Was aber häufiger auftretende Krankheiten, an denen wir alle erkranken können, betrifft, so liefert die genetische Untersuchung zusätzlich zu den Informationen, die aus der Familienanamnese und der klinischen Untersuchung bekannt sind, allerdings nur wenig Neues. Auch wenn sich diese Situation wahrscheinlich noch ändern wird, bedeutet unser derzeit begrenztes Wissen, dass wir uns vor einer Überbewertung der Risiken für die häufigen Krankheiten, die sich auf der Grundlage von Genanalysen vorhersagen lassen, hüten müssen.
Wir sollten an dieser Stelle erklären, dass keiner der Autoren dieses Buchs sein genetisches Profil in Auftrag gegeben hat oder dies zu tun beabsichtigt. Deshalb sollte es Sie auch nicht wundern, dass wir uns im Allgemeinen gegen genetische Untersuchungen aussprechen, es sei denn, ein Patient hat entweder eine Familienanamnese, die Anhaltspunkte gibt für das Vorliegen einer bestimmten bekannten erblichen Krankheit oder eine der wenigen derzeit bekannten Krankheiten, bei denen ein Gen oder mehrere Gene eindeutig vorhersagen, wer von ihnen auf eine Therapie ansprechen wird.
Frage 6: Wie kann jemand, der an einer Krankheit leidet, die gerade in einer laufenden klinischen Studie untersucht wird, und dessen Arzt nichts von dieser Studie weiß, doch etwas darüber herausfinden?
Weniger als einer von 100 Arztbesuchern wird für eine klinische Studie angemeldet. Je nach Krankheit und äußeren Bedingungen unterliegt dieser Anteil erheblichen Schwankungen. Selbst innerhalb von Krebszentren – in denen Studien allgemein anerkannt sind und weithin genutzt werden – herrscht in diesem Punkt eine enorme Bandbreite: Die meisten an Krebs erkrankten Kinder werden in Studien aufgenommen, aber bei den Erwachsenen sind es weniger als einer von zehn. In den meisten Fällen richtet sich die Aufnahme in eine Studie danach, welches Zentrum der Patient zur Behandlung aufsucht: Nimmt das Zentrum nicht an einer Studie teil, dann können sie auch keine Patienten rekrutieren. Deshalb müssen sich Patienten unter Umständen nach einem Zentrum erkundigen, das sich an klinischen Studien beteiligt. Es gibt einige ambulante Studien, für die sich Patienten direkt anmelden können. Solche Studien werden häufiger im Rahmen von Forschungsvorhaben durchgeführt, anhand derer man herausfinden möchte, wie man Menschen mit psychischen Gesundheitsproblemen wie z. B. einer Depression oder Angststörung helfen kann. Für einige andere Studien werden die Teilnehmer neuerdings auch direkt über das Internet rekrutiert. Beispielsweise wurden für eine vor kurzem durchgeführte Studie, in der die Wirkungen von Dehnübungen vor der Aufnahme sportlicher Aktivitäten beurteilt werden sollten, alle Teilnehmer auf diese Weise rekrutiert: Sie haben niemals eine Klinik aufgesucht, sondern sämtliche Anweisungen über das Internet erhalten. Auch die Nachbeobachtung wurde über das Internet durchgeführt.
Wenn Ärzte zögern, ihre Patienten für die Teilnahme an Studien anzumelden, sollten die Patienten versuchen, den Grund dafür herauszufinden. Es könnte beispielsweise sein, dass der Patient nicht wirklich für die Studienteilnahme geeignet ist. Es kann aber auch einfach daran liegen, dass der Arzt die zusätzliche Arbeit in der Form von belastenden regulatorischen Anforderungen scheut (s. Kap. 9). Patienten, die glauben, dass sie sich wahrscheinlich für die Teilnahme an einer laufenden Studie eignen, sollten daher nicht locker lassen. Wenn eine passende Studie läuft und ein Patient klarstellt, dass er unbedingt daran teilnehmen möchte, sollte sein Arzt dies unterstützen (s. a. Zusätzliche Quellen).
Frage 7: Wie lässt sich am besten feststellen, ob die Evidenz (im Netz oder anderswo) zuverlässig ist? Worauf sollte man dabei achten?
Leider gibt es keine hundertprozentig verlässlichen Kennzeichen, an denen sich ablesen lässt, ob eine Information zuverlässig ist. Wenn man sich selber nicht mit der Originalliteratur befassen will, muss man sich in diesem Punkt auf die Einschätzung Dritter verlassen. Deshalb ist es wichtig, die mutmaßliche Kompetenz der betreffenden Person (oder Organisation) zu beurteilen und festzustellen, ob es da irgendwo Interessenkonflikte (oder eine offene Rechnung) gibt. Wenn nicht, sollten Sie sich fragen, ob Sie darauf vertrauen, dass diese Person die besten Forschungserkenntnisse aufgespürt und ausgewertet hat: Wurden die Forschungsergebnisse beschrieben? Sind entsprechende Literaturangaben vorhanden?
Angenommen, jemand möchte z. B. wissen, ob Beta-Carotin (Vorstufe von Vitamin A) das Krebsrisiko erhöht oder es senkt. Eine Suche in Google nach «beta-carotene cancer» liefert mehr als 800000 Treffer. Sieht man sich die ersten zehn Treffer an, dann finden sich darunter vier Primärstudien und sechs Übersichtsarbeiten oder Meinungen. Unter dreien dieser sechs Links standen Werbeanzeigen für Vitamine oder alternative Medikamente auf derselben Seite: ein beunruhigendes Zeichen.
Auf einer dieser schlechteren Webseiten heißt es:
Frage: Beugt Beta-Carotin Krebs vor? Antwort: Studien haben gezeigt, dass Beta-Carotin helfen kann, das Krebsrisiko zu senken. Beta-Carotin kommt in gelben, roten und dunkelgrünen Gemüsesorten, aber auch in Früchten vor. Man geht allgemein davon aus, dass die Einnahme eines Beta-Carotin-haltigen Nahrungsergänzungsmittels dieselbe Wirkung hat wie der Verzehr von Obst und Gemüse, das Beta-Carotin enthält. Dies ist aber nicht der Fall. In Studien wurde unter den Studienteilnehmern ein erhöhtes Lungenkrebsrisiko festgestellt.
Abgesehen von den Werbeanzeigen werden zwar «Studien» erwähnt, sie werden aber nicht näher beschrieben bzw. es werden keine Literaturangaben zu veröffentlichten Studien gemacht – das sollte Sie aufhorchen lassen. Es lässt sich unmöglich sagen, ob der Autor diese «Studien» recherchiert und ausgewertet hat oder lediglich über Studien gestolpert ist, deren Schlussfolgerungen ihm gefallen haben.
Stellen wir dieser Website den Eintrag in Wikipedia gegenüber (der ebenfalls unter den ersten zehn Treffern genannt wird):
Eine Übersichtsarbeit über alle randomisierten, kontrollierten Studien im wissenschaftlichen Schrifttum, die von der Cochrane Collaboration erstellt und 2007 in JAMA veröffentlicht wurde, ergab, dass Beta-Carotin die Sterblichkeit um 1 bis 8 % erhöht (relatives Risiko 1,05, 95 %-Konfidenzintervall 1,01 bis 1,08).[15] Allerdings umfasste diese Meta-Analyse zwei große Studien über Raucher, sodass nicht klar ist, ob die Ergebnisse auf die Allgemeinbevölkerung übertragbar sind.[16]
Dieser Eintrag nennt die Art der Evidenz (randomisierte Studien) und gibt die Literaturstellen an (die hochgestellten Zahlen in eckigen Klammern). Die Tatsache, dass keine Werbeanzeigen auf der Seite zu finden sind und spezifische Angaben zur Evidenz gemacht werden, schafft Vertrauen.
Frage 8: Gibt es zuverlässige, empfehlenswerte Informationsquellen?
Es gibt keine Informationsquelle, die über alle Krankheiten und Therapien Auskunft gibt. Um die in diesem Buch vorgestellten Prinzipien anzuwenden, möchte vielleicht der eine oder andere Leser seine Fertigkeiten in diesem Bereich noch weiterentwickeln. Ergänzend zu Kapitel 6 bis Kapitel 8 in diesem Buch gibt das Buch Smart Health Choices [5] etliche Tipps, wie man hochwertige Gesundheitsinformationen findet und worauf man dabei achten sollte. In Zusätzliche Quellen finden Sie weitere Lektüreempfehlungen.
Nur wenige der vorhandenen Webseiten beruhen vorwiegend auf systematischen Übersichtsarbeiten. Zu diesen gehören die Cochrane Database of Systematic Reviews (www.cochrane.org/cochrane-reviews oder summaries.cochrane.org), die vorwiegend englischsprachige Zusammenfassungen für Laien enthält, sowie die Internetseite des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG; www.gesundheitsinformation.de). Zudem gibt es zahlreiche Webseiten in englischer Sprache, die generell gute Informationen bereitstellen, sich aber nicht immer auf systematische Reviews der besten verfügbaren Evidenz stützen – beispielsweise NHS Choices (www.nhs.uk) und PubMed Health (www. pubmed.gov/health).
Natürlich muss man auf der Hut sein. Achten Sie vor allem auf Interessenkonflikte, etwa auf Internetseiten, denen finanzielle Vorteile daraus erwachsen, wenn die Besucher der Webseite die angebotenen Informationen glauben, oder Seiten, die etwas zu verkaufen versuchen. Manchmal lässt sich das allerdings nur schwer erkennen: Beispielsweise erhalten, wie in Kapitel 11 erwähnt, manche Patientenvertretungen finanzielle Unterstützung von Pharmaunternehmen, die nicht deklariert ist und den dargebotenen Informationen eine gewisse «Färbung» verleiht.
Frage 9: Wie kann man vermeiden, dass man mit einem «Krankheitsetikett» versehen und unnötig behandelt wird
Die Medizin hat erstaunliche Fortschritte gemacht: z. B. Impfstoffe und Antibiotika zur Verhütung und Behandlung von Infektionen, Gelenkersatz, Kataraktoperation und die Therapie von Krebserkrankungen bei Kindern, um nur einige wenige zu nennen. Doch dieser Erfolg verführt die Medizin auch dazu, ihre Fühler in Bereiche vorzustrecken, in denen sie weniger Nutzen mit sich bringt. Für einen Mann mit einem Hammer sieht die ganze Welt wie ein Nagel aus, und für einen Arzt (oder einen Arzneimittelhersteller!) mit einer neuen Therapie sieht alles nach Krankheit aus. Weil z. B. bessere Therapien gegen Diabetes und Bluthochdruck verfügbar geworden sind, sind Ärzte versucht, die Anwendung dieser Therapien auch ihren Patienten vorzuschlagen, deren Befunde nur geringfügig von den Normalwerten abweichen. Dadurch steigt die Anzahl der Menschen, die als Diabetiker oder Hypertoniker etikettiert werden, dramatisch an, sodass viele Menschen «medikalisiert» werden, deren Werte früher als normal eingestuft worden wären.
Abgesehen von den unerwünschten Wirkungen der (zuweilen unnötigen) Behandlungen hat diese «Etikettierung» auch psychische und soziale Konsequenzen, die das persönliche Wohlbefinden beeinträchtigen und Probleme am Arbeitsplatz oder beim Versicherungsträger mit sich bringen können. Deshalb ist es für Patienten und Öffentlichkeit wichtig, diese Ereigniskette zu erkennen und erst einmal innezuhalten, um den wahrscheinlichen Schaden gegen den Nutzen abzuwägen, bevor man einer Therapie allzu schnell zustimmt. Wie wir in Kapitel 4 dargelegt haben, sind für diese problematische Etikettierung häufig Screenings verantwortlich, die mit Überdiagnosen und potenzieller Übertherapie einhergehen.
Die erste Verteidigungsstrategie ist Wachsamkeit gegenüber solchen Etiketten und weiteren Untersuchungsangeboten. Die scheinbar flapsige Bemerkung, dass ein normaler Mensch jemand ist, der noch nicht ausreichend untersucht wurde, hat einen sehr ernsten Hintergrund. Deshalb ist es klug, stets nachzufragen, ob eine Krankheit mit einem hohen oder einem niedrigen Risiko einhergeht, und auch zu fragen, was passieren könnte, wenn man erst einmal abwarten würde: Wie könnte die Krankheit überwacht werden, und was wäre ein Zeichen dafür, dass man handeln müsste? Manche Ärzte sind erleichtert, wenn Patienten nicht gleich behandelt werden wollen oder nicht sofort weitere Untersuchungen verlangen. Es gibt aber auch Ärzte, die in die Etikettenfalle – Etikett = Krankheit = obligatorische Behandlung – hineintappen, weil sie nicht erkennen, dass der Patient vielleicht damit zufrieden wäre, erst einmal abzuwarten, um zu sehen, ob seine Beschwerden von allein besser werden oder sich verschlimmern.
| Wer ist Diabetiker? |
| Wie wird also entschieden, wer Diabetes hat? Als ich Medizin studierte, galt folgende einfache Regel: Wenn man einen Nüchternblutzucker von mehr als 140 hatte, war man Diabetiker. 1997 wurde diese Krankheit vom Expert Committee on the Diagnosis and Classification of Diabetes Mellitusneu definiert. Danach gilt man bereits ab einem Nüchternblutzuckerspiegel von 126 als Diabetiker. Jeder, der einen Blutzuckerspiegel zwischen 126 und 140 hat, wurde früher als normal angesehen, leidet nach dieser Definition nun aber an Diabetes. Diese geringfügige Änderung hat aus mehr als 1,6 Millionen Menschen Patienten gemacht. Stellt das ein Problem dar? Kann sein, kann auch nicht sein. Weil wir die Regeln geändert haben, behandeln wir heute mehr Menschen wegen Diabetes. Das kann bedeuten, dass wir bei einigen dieser neuen Patienten die Wahrscheinlichkeit für die Entwicklung diabetischer Komplikationen verringert haben. Doch da diese Patienten einen leichteren Diabetes haben (d. h. vergleichsweise niedrige Blutzuckerspiegel zwischen 126 und 140), ist ihr Risiko für diese Komplikationen aber zunächst einmal auch vergleichsweise gering.
Welch HG, Schwartz LM, Woloshin S. Overdiagnosed: making people sick in the pursuit of health. Boston: Beacon Press, 2011: S. 17–18. |
